科技日報記者 劉霞
美國得克薩斯大學西南醫(yī)學中心研發(fā)的新型基因編輯遞送系統(tǒng),在α-1抗胰蛋白酶缺乏癥(AATD)臨床前模型上實現(xiàn)了肝臟與肺部的同步靶向治療。單次給藥后,模型癥狀改善效果可持續(xù)數(shù)月。這項發(fā)表于最新一期《自然·生物技術(shù)》雜志的研究,為多器官遺傳疾病的治療開辟了新途徑。
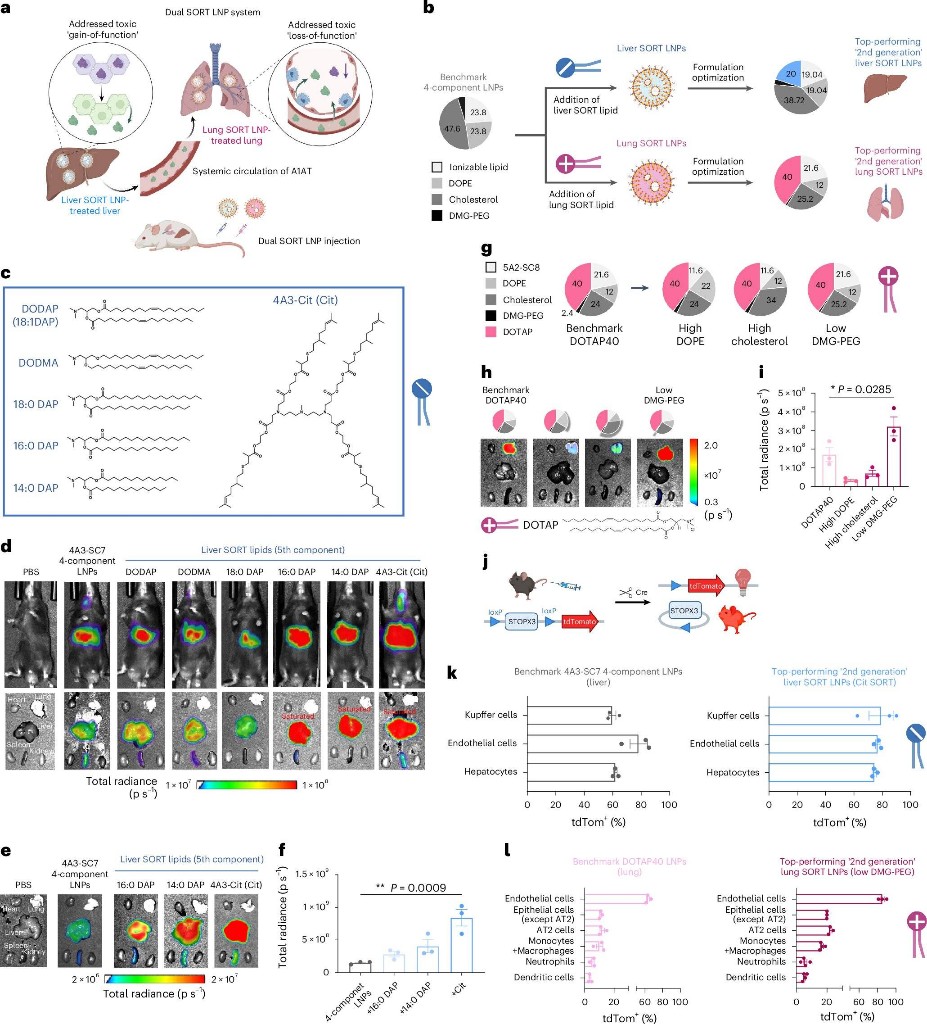
2020年,該團隊首創(chuàng)的選擇性器官靶向(SORT)技術(shù)通過定制脂質(zhì)納米顆粒的成分,實現(xiàn)了對肝臟、肺臟等器官的選擇性基因修飾。但多器官同步靶向始終是未解的難題。而這一突破對AATD治療尤為重要。該疾病源于SERPINA1基因單核苷酸突變,導(dǎo)致肝臟積聚毒性蛋白。而該基因編碼的正常蛋白本應(yīng)保護肺組織免受酶解破壞,因此患者同時面臨肝損傷與肺氣腫的雙重威脅。
團隊通過兩大創(chuàng)新攻克了這一難題。首先,他們重構(gòu)了SORT納米顆粒結(jié)構(gòu),使其能搭載更大的基因編輯蛋白;同時,他們開發(fā)了新型肝臟與肺部雙靶向配方,顯著提升了遞送效率和精準度。
實驗顯示,患者來源肝細胞的基因編輯效率得到顯著提升。AATD模型小鼠接受單次治療后,約40%肝細胞和10%肺泡AT2細胞(AATD主要靶細胞)被成功修復(fù);肝臟突變蛋白水平持續(xù)32周穩(wěn)定降低80%。治療4周后,小鼠模型肝內(nèi)毒性蛋白聚集體完全清除。盡管小鼠模型未能完全模擬人類肺部病變,但單次治療后,肺部破壞性酶活性被抑制89%。